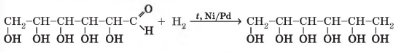Мета: Порівняти природні та синтетичні органічні сполуки
Природні органічні сполуки
Ми вже вивчили такі природні сполуки як білки, жири, вуглеводи, крохмаль, целюлозу, амінокислоти, нуклеїнові кислоти. Розглянемо деякі інші речовини.
Волокна. Людина тривалий час широко використовує природні волокнисті матеріали для виготовлення одягу й різних виробів домашнього вжитку. Одні з цих матеріалів мають рослинне походження й складаються з целюлози, як, наприклад, льон, конопля, бавовна й інші – тваринного походження, що складаються з білків (вовна, шерсть, шовк).
Природні барвники. Ще близько ста років тому застосовувалися природні барвники, які добували із соків різних рослин, з тіл комах, залоз молюсків, що живуть на дні моря – багрянок. Так, наприклад, відомий античний пурпур, яким фарбували багряні накидки римських патриціїв та імператорів мав бруднувано-бузковий відтінок. Його виготовляли із залоз молюсків. Щоб добути 1 кг цієї фарби, треба було виловити з дна моря близько 8000 молюсків багрянок. Червону фарбу кармін виготовляли з висушених самок кошенілі – комах, що живуть на кактусах в Америці, а також з дерева – червоного сандала. Синю фарбу індиго добували з рослини індигоноски, а коричневу – з соку тропічних акацій й мімоз. Жовту фарбу добували з дерева – жовтого сандала. Культури цих рослин займали великі площі, а фарбування потребувало великих витрат часу й великої майстерності.
Віск. Деякі рослини покривають ним тоненьким шаром свої стебла, листя й оболонки наземних частин рослин, що виконує захисні функції.
Смоли. Дуже складні за хімічним складом речовини. Вони служать пластирем у випадку поранення рослини.
Лігнін. Це теж високомолекулярна сполука, яка просочує стінки клітин й скріплює їх одна з одною, сприяє одерев’янінню рослиної тканини.
Каучук. Високоеластичний матеріал рослинного походження, який застосовується для виготовлення ґуми й ґумових виробів. Каучук міститься в молочному соці гевеї, кок-сагизу та інших рослин каучуконосів.
Синтетичні органічні сполуки
Синтетична органічна хімія подарувала людству величезну кількість речовин, яких не існує в природі. До того ж, значно дешевших порівняно з виділеними із природної сировини. Тепер синтезовано багато органічних речовин, не тільки тих, які зустрічаються в природі, а й тих, яких у природі немає, але які є конче потрібні людині в житті та її виробничій діяльності. Це може стосуватися, наприклад, численних пластмас, різних видів каучуку, всіляких барвників, які перевершують за яскравістю відтінків природні, вибухові речовини, лікарські препарати.
Зазначимо найважливіші галузі промисловості, які виробляють органічні сполуки або переробляють органічну сировину: паливо й каучук необхідні сучасному транспорту; наша їжа й одяг; різноманітні фарби й синтетичні барвники; нафтохімічна, фармацевтична, лакофарбова промисловості; виробництво засобів боротьби із шкідниками в сільському господарстві; вітаміни, ферменти, гормони та інше. Останнім часом винятково важливого значення набуло виробництво синтетичних високомолекулярних сполук – полімерів. У наші дні особлива роль належить органічній хімії в розробці методів добування речовин, які замінюють такі харчові продукти, як жири, масло, олію. Не менш важлива роль органічної хімії в переробці сільськогосподарських продуктів, нафти, природного газу й кам’яного вугілля.
Синтетично добутих речовин тепер відомо навіть більше, ніж знайдено у природі. З кожним роком кількість їх збільшується на десятки тисяч. Органічна хімія стоїть на шляху до синтезу найскладніших органічних речовин – білків.
Полімери
Полімери (гр. polimeres – «багато частин») – це продукти сполучення багатьох однакових молекул в одну велику молекулу, внаслідок чого змінюються властивості вихідного продукту. Крім поліетилену, властивості якого ми вивчали, існує багато інших полімерів. Властивості полімерів залежать від молекулярної маси, хімічного складу й структури молекул. Вони бувають то легкі як пух, то прозорі, як повітря, то еластичні, то надзвичайно тверді й хімічно стійкі, механічно міцні або хрупкі, нелеткі, гігроскопічні, діелектрики, одні не плавляться, інші – не горять, виявляють високу стійкість до агресивних середовищ, високу витривалість до стирання. Пластмаси замінили метал у різних виробах (деталі машин, броня), скло та папір. Біля 80% продукції електротехнічної промисловості випускається з використанням полімерів, 1/5 всіх добутих полімерів використовують у машинобудуванні. Широко застосовуються полімери й у будівництві.
Полівінілхлорид широко використовують для виготовлення лінолеуму, лицювальної плитки, водопровідних труб (значно міцніших за поліетиленові), як ізоляційний матеріал для електричних проводів. Завдяки високому вмісту хлору полівінілхлорид не підтримує горіння (самозатухає), але незезпечний тим, що при високій температурі розкладається з виділенням отруйних газів та діоксину.
Полістирол – для виготовлення посуду, іграшок, лицювальної плитки. Полімери стиролу займають третє місце у світовому виробництві пластмас.
Поліпропілен міцніший за поліетилен. Це тверда, жирна на дотик речовина молочнобілого кольору. Використовується для виробництва деталей машин, труб гарячого водопостачання, деталей різноманітних апаратів, плівок, побутові вироби, волокон, високотривких ізоляційних матеріалів. Стійкість полімеру проти багаторазових вигинів й стирання дає можливість добувати з нього міцні волокна для виготовлення канатів, риболовних сіток, фільтрувальних тканин. Недоліком цієї пластмаси є чутливість до світла, кисню, крихкість на холоді.
Тефлон (F2C–CF2) за особливу стійкість його назвали «органічною платиною». Він не розчиняється ні у «царській горілці», ні в органічних розчинниках. Стійкий проти холоду й нагрівання, світлостійкий, неотруйний. З нього виготовляють деталі машин й приладів, апаратів, що працюють у хімічно агресивному середовищі, у харчовій та електротехнічній промисловості, для виготовлення протезів судин, які легко затягуються клітинами тіла. З побутових виробів нам знайомі пательні та каструлі з антипригарним тефлоновим покриттям.
Пластичні конструкційні матеріали на основі органічних полімерів називають пластмасами. Їх пластичність дозволяє виготовляти з них вирооби методами пластичної деформації при підвищеній температурі – гарячого пресування, лиття під тиском. Пластмаса витісняє метал, тому що вироби з неї легкі й водночас міцні. Із полімерів виготовляють одяг, взуття, посуд, іграшки, прикраси, використовують в побуті й сільському господарстві. У медицині – пластикові протези різних органів або частин тіла, пластикові мембрани в різних органах, для виготовлення селективних агентів, здатних нести специфічні лікарські препарати в певне місце організму без витрати їх на інші органи. Як тільки людина навчиться синтезувати молекули, подібні ферментам, медицина зможе лікувати різні складні захворювання.
Фотохромні матеріали. Спеціалісти вважають, що найперспективніша галузь – це техніка інформації з використанням фотохромних матеріалів. За допомогою фотохромних барвників можливе суперкінофільмування із зменшенням оригіналу у десятки тисяч разів. Цим способом було сфотографовано всі 1245 сторінок Біблії на прозору пластину розміром менше двох квадратних дюймів. Фотохромні барвники використовують для виготовлення спеціального скла окулярів. Такі окуляри світліють в тіні, або на заході сонця, оберігаючи зір від яскравих спалахів.
Із полімерів виготовляють синтетичні волокна. Так синтетичне волокно «Лола» не горить при температурі +1200°С, а лише розжарюється, стійке до кислот й розчинників. Його використовують для виготовлення вогнезахисного одягу. Термостійке волокно «Армід» витримує температуру +300°С, +400°С, не горить, не плавиться, стійке до радіаційного й ультрафіолетового випромінення.
До полімерів належать й синтетичний каучук, ґума. Світове використання каучука складає близько 20 млн/т на рік. Каучук застосовують для виготовлення камер для автомобілів, літаків, роверів, ґумового взуття, ізоляції електропроводів, численних медичних виробів.
Домашнє завдання § 34, вправа 234.
Проводимо експеримент: поріжте свіжі листки червоної капусти, прокип’ятіть їх з водою. Листки капусти стали зеленими. Злийте лиловий відвар. Розчин добутого індикатора добавляйте у п’ять склянок відповідно:
а) з газованою водою;
б) розчином нашатирного спирту;
в) розчином алюмо-калієвого галуну;
г) розчином сульфатної кислоти;
д) водою.
Речовина в першій склянці стане червоною, у другій – зеленою, у третій – пурпуровою, у четвертій – безбарвною, у п’ятій – синьою.